Lidt om salt (NaCl) - Natriumchlorid
|
|
68,5 tons salt i timen, det er hvad den eneste
saltproducent i de nordiske lande producerer - døgnet rundt. Og den ene
saltproducent hedder med et lidt kryptisk (mystisk) navn: Akzo Nobel Salt og
er placeret i Mariager. |
|
|
Rent kemisk er salt en ion forbindelse der er sammensat af Na+ og Cl- ioner. Disse sidder i et såkaldt iongitter. For salts vedkommende er dette iongitter kubisk - hvilket betyder terningeformet. Og dette kan illustreres på forskellig måde - hvilket ses til venstre - billedet øverst er fra saltcenteret. De gule Na ioner er meget mindre end de grønne chlorid ioner. Billedet nederst er den model vi har i fysiklokalet på Højene Skole - og det er nok den du kender. |
|
|
Og alle ved vi at salt kan opløses i vand - det vender vi
tilbage til - men hvorfor er det nu sådan?. Vi kan se på vandstrålen til
højre for denne tekst. Den er tydeligvis afbøjet. Og det der afbøjer er den
er den statisk elektriske plasticstang. Vi kan på denne måde konstatere at
vand reagerer på elektriske kræfter. Og da ioner er elektrisk ladede
atomer ( eller grupper) så kan vi her søge forklaringen på at vand kan opløse
salt. |
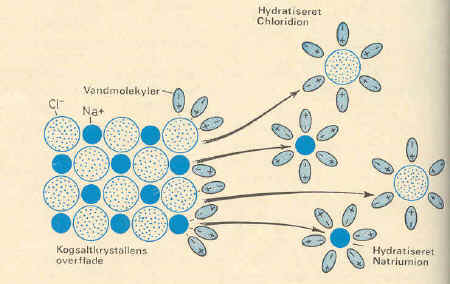
Billedet her er scannet fra: kemi i grundtræk, bind 1 - Munksgaard 2.
oplag 1982

