Molmasse
samt opvarmning af natriumhydrogencarbonat
g og kg er egentlig en enhed kemikere slet ikke kan lide, vi vil hellere regne i mol og molmasser. 1 mol af et stof er det antal g som molekylemassen direkte lagt sammen angiver. Allerede nu lyder det som volapyk, men det periodiske system I har fået udleveret har allerede øverst angivet den gennemsnitlige atommasse for stoffet. Og det er det tal vi skal bruge. Og da vi ikke skal finde neutron antallet skal vi for en gangs skyld ikke afrunde tallet.
men bruge 1 eller 2 decimaler… Lad os tage et eksempel:
Vand hedder H2O
H vejer 1,01 u, dem er der 2 af = 2,02 u
O vejer 16 u
Samlet er atommassen for et vandmolekyle således 18,02 u
Erstatter vi nu "u" med enheden g kan vi sige:
1 mol vand = molmassen for vand = 18,02 g
1 mol af et eller andet stof indeholder altid: 6,02 * 1023 af det stoffet består af.
Der er altså det kolossal store tal af vandmolekyler i 18,02 ml vand = 18,02 g vand da 1 ml vand vejer 1 g. 1 liter vand = 1000 g er så lig med 1000/18,02 = 55,49 mol man kan altså finde moltallet af et eller andet stof ved at sige
Salt (NaCl) har molmassen 58,44 (Na + Cl s masse)

Pakken på billedet der indeholder 1 kg indeholder derfor:
1000/58,44 = 17, 11 mol (prøv at gå til købmanden for at bede om 17,11 mol natriumchlorid)
Det kan man lave en øvelse med, og her lærer du også noget om reaktionsskemaer: Til denne øvelse anvendes der følgende apparatur og kemikalier:
- En smeltedigel af metal med låg
- En trefod
- En bunsenbrænder
- Et keramisk net
- NaHCO3 (Natriumhydrogencarbonat)
Desuden lommeregner og det periodiske system. Øvelsen udføres således:
Den tomme digel + låg vejes på specialvægten, og resultatet noteres ned som det viser sig med 2 dec. nøjagtighed.
Hvis special vægten ikke dur, tages den almindelige digitalvægt
Forinden er diglen godt gennemglødet, og rengjort. Den skal osse være 100% tør. (Det er jo ikke vanddråber vi skal veje) Derefter i hældes et par tsk. NaHCO3. Dette resultat noteres osse ned. Fra dette det sidste resultat fratækkes den første vejning. Og vupti. I har nu det antal g af NaHCO3 i har puttet i diglen. Der skal nu foretages følgende beregninger:
Beregn MOLMASSEN for NaHCO3. Det vil sige I gør
følgende:
Find hvert enkelt element i det periodiske system og adder disse. man finder
altså hvad
Na vejer:
H vejer:
C vejer:
O vejer:
Husk "O" skal multipliceres (ganges) med 3.
(2) Beregn MOLTALLET for præcis den mængde I har fået "hældt" i diglen.
Dette gøres således: Moltallet = det antal g I har/ Molmassen for NaHCO3. Når dette er overstået anbringes digel + låg på en trefod med net, og så skal der altså bare varmes op… Denne opvarmning foregår i mindst 20 minutter. Det er lang tid, men det er nødvendigt, derefter køles diglen af, og når det er tilstrækkeligt gjort, vejes denne igen, det er altså den tredje vejning… Derefter laves følgende beregning:.
(3) Hvor meget er der i g tilbage i diglen. Dette resultat i (3) skulle gerne vise, at massen af det stof der er tilbage, er mindre end det det var da vi startede. Dette er et tegn på, at der er sket en såkaldt kemisk reaktion. Det oprindelige Natriumhydrogencarbonat er omdannet til noget andet. Der er med andre ord, forsvundet noget af dette stof, og vi har nu et nyt. Problemet er så : Hvad har vi nu fået? Lad os se på et par mulige løsninger: Man kunne tænke sig til nogle reaktioner der kunne finde sted, og de kunne jo fex. se ud som følger, og her er det vigtigt at huske det krav der altid er til reaktioner: De skal skrives op så der er lige mange involverede atomer på begge sider af den pil der fortæller i hvilken retning reaktionen går: Reaktion 1: NaHCO3 + varme → NaOH + CO2. Da kuldioxid er en luftart kunne man nemt tænke sig, at det var den der forsvandt, og dermed kunne massetabet forklares. Og reaktionen opfylder kravene om lige mange atomer på begge sider. Her er det nu der kommer mol-beregninger ind i billedet.
Reaktionen kan osse skrives sådan her:
1 NaHCO3
+ varme → 1 NaOH +1 CO2
eller:
2 NaHCO3
+ varme → 2 NaOH +2 CO2
Ved den sidste opfylder vi stadig antallet af atomer er lige stort på begge sider af pilen.
Det er ganske vist overflødigt med de to-taller. De er jo ens overalt, hvorfor man lige så godt kan dividere med to.
Men I KEMI-SPROG kan vi osse skrive flg:
1 mol NaHCO3
+ varme → 1 mol NaOH + 1 mol CO2
Nu er det her pæne tal, det kunne fex. være 0.076 mol vi har af natrium-hydrogen-carbonatet.
Så vil det se sådan ud:
0.076 mol NaHCO3 + varme vil give 0.076 mol NaOH + 0.076 mol CO2
(nu
tager jeg lige en kop kaffe)
Lad os lige regne med de pæne tal:
1 mol NaHCO3 vil altså give 1 mol NaOH
Kuldioxiden interesserer vi os ikke for..den er feset væk under opvarmningen(det er jo en luftart), så det faste stof der er tilbage kan tænkes at være NaOH.
Molmassen for NaHCO3 = 84,00 g
Molmassen for NaOH = 40,00 g
Vi ved at antallet af mol for det dannede NaOH skal være 1.
og vi husker formlen
Det kan vi så sætte ind i de formler vi kender:
Vi sætter så tal ind:
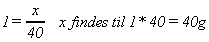
Vi skal med andre ord have 40g tilbage i diglen, hvis det 1 mol natriumhydrogencarbonat vi er startet med.
Det er det selvfølgelig ikke.
Opgave: Regn med jeres eget "skæve moltal"
Hvor mange g af NaOH skal I have tilbage i diglen,
og passer det med de faktiske forhold?
Det var jo rimeligt enkelt
En anden proces der osse kunne virke vil se sådan ud:
2 NaHCO3
+ varme -> Na2CO3 + H2O + CO2
Her er der osse lige mange atomer, på begge sider af reaktions-pilen. Den kan så osse skrives med "moltal":
2 mol NaHCO3 + varme > 1 mol Na2CO3 + vanddampe og kuldioxid
eller lidt mere matematisk udtrykt n-mol NaHCO3 -> n/2 mol Na2CO3
Opgave: Prøv at regne denne proces igennem med jeres egne tal
(molmassen for natrium-carbonat er 105.99)
Hvilken af disse 2 processer passer altså bedst med det i faktisk har tilbage i diglen. I har jo selv en del tal, og de er gode at kontrollere dette med. Læg mærke til at øvelsen også omhandler lidt om reaktionsskemaer. Det bliver sjovt nok betragtet som noget svært, men det er bare at tælle de "atomer" der indgår på begge sider af en reaktionspil. Atomer er sat i "" fordi, det tit er ioner der er reagerer med hinanden.